Що таке клінічні випробування, та чи потрібні вони українцям
У всьому світі проведення клінічних випробувань, або досліджень, вважається найкоротшим шляхом до інноваційних ліків, а їх кількість давно стала мірилом розвиненості країни.
В Україні ж продовжує жити міф, що клінічні випробування – це досліди над людьми, й нічого хорошого ні пацієнту, ні країні вони дати не можуть.
У США сьогодні здійснюється 14 тисяч клінічних випробувань, близько 1200 – у Польщі, тоді як в Україні триває лише 270.
Така прірва в кількості клінічних випробувань між нами та високо розвиненими країнами не може не викликати запитань.
Щоб раз і назавжди розвіяти міфи, давайте розберемось, у чому насправді полягає суть клінічних досліджень, хто, де і як їх проводить та чому вони необхідні як пацієнтам, так і державі.
ЩО ТАКЕ КЛІНІЧНЕ ВИПРОБУВАННЯ?
Майже жоден лікарський засіб в Україні не може бути зареєстрований без результатів клінічних випробувань (КВ), адже вони доводять його ефективність та безпеку.
Винятками є добре вивчені лікарські засоби, наприклад, зеленка і йод, а також препарати, що знаходяться на фармацевтичному ринку України більше 10 років.
Окрім нових препаратів, досліджувати можуть і відомі лікарські засоби для підтвердження їх ефективності та безпеки за новими показаннями.
За допомогою КВ можуть також перевіряти, чи змінюється дія препарату в разі одночасного приймання пацієнтом інших лікарських засобів.
Ніщо так не гарантує безпеку клінічного випробування для пацієнта та отримання достовірних результатів для його організаторів, як правильно складений протокол.
Протокол клінічного випробування – це план, що містить детальну інформацію про умови майбутнього випробування.
Наприклад, у ньому зазначено результати доклінічних досліджень, визначено, за якими критеріями обиратимуть пацієнтів для КВ, як часто пацієнта обстежуватимуть під час дослідження та який час лікарі супроводжуватимуть його по завершенню КВ, коли він припинить приймати препарат.
Протокол випробування ретельно аналізується відповідними департаментами Державного експертного центру (ДЕЦ).
Експерти, зокрема, розглядають мету та всі умови КВ, зважують користь і ризик для пацієнта, дивляться, чи не було виявлено за результатами доклінічних досліджень (на тваринах) препарату чогось, що може нашкодити пацієнту, й дають свій висновок.
Організатор випробування має обов’язково отримати два дозвільних документи.
На підставі позитивного експертного висновку ДЕЦ видається наказ Міністерства охорони здоров’я, яким затверджується протокол КВ.
Другий дозвільний документ – висновок локальної етичної комісії медичного закладу, де планується проведення КВ.
Лише після цього клінічне випробування можна розпочинати.
ЯК ПРОВОДЯТЬ КЛІНІЧНІ ВИПРОБУВАННЯ?
Клінічні випробування проводять у чотири фази.
В Україні найбільш поширені клінічні дослідження ІІІ фази – масштабні дослідження з залученням сотень або навіть тисяч хворих для підтвердження ефективності й безпеки лікарського засобу, необхідного дозування, збору інформації про побічні реакції тощо.
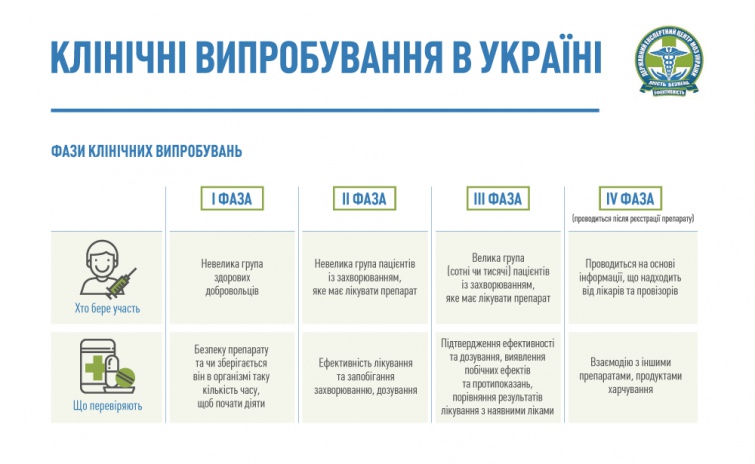 |
| В Україні найбільш поширені клінічні дослідження ІІІ фази. Для збільшення натисніть на малюнок |
Найбільш інформативним вважається подвійне сліпе клінічне дослідження. Воно передбачає розподіл пацієнтів на дві групи, одна з яких отримує досліджуваний лікарський засіб, а друга – плацебо (такий же на вигляд препарат, але без діючої речовини).
За умовами цього дослідження, ні пацієнт, ні лікар не знають, якій із груп прописано плацебо. Про це відомо лише організаторам клінічного дослідження.
Таким чином можна отримати найбільш об’єктивні результати щодо ефективності препарату.
При цьому, пацієнт, який приймає плацебо, ніколи не піддається ризику, адже він отримує одночасно й базову, стандартну або дозволену за протоколом терапію, потрібну для підтримання його хорошого самопочуття та лікування відповідного захворювання.
ДЕ І ХТО ПРОВОДИТЬ КЛІНІЧНІ ВИПРОБУВАННЯ?
КВ проводять у будь-яких лікувально-профілактичних закладах, які мають необхідну клінічну базу та медичний персонал із потрібною кваліфікацією.
Найчастіше клінічні дослідження проводяться в обласних та міських лікарнях, клініках науково-дослідних інститутів, на клінічних базах кафедр медичних університетів.
СКІЛЬКИ КЛІНІЧНИХ ВИПРОБУВАНЬ ПРОВОДИТЬСЯ В УКРАЇНІ?
Сьогодні в Україні проводиться близько 270 клінічних досліджень, найбільше – в галузі онкології.
Щоб зрозуміти, мало це чи багато, можна порівняти кількість КВ на 100 тисяч населення станом на липень 2017 року.
За цим показником Україна вже кілька років підряд більш ніж удвічі програє нашим сусідам – Польщі та Румунії.
 |
| Сьогодні в Україні проводиться близько 270 клінічних досліджень. Для збільшення натисніть на малюнок |
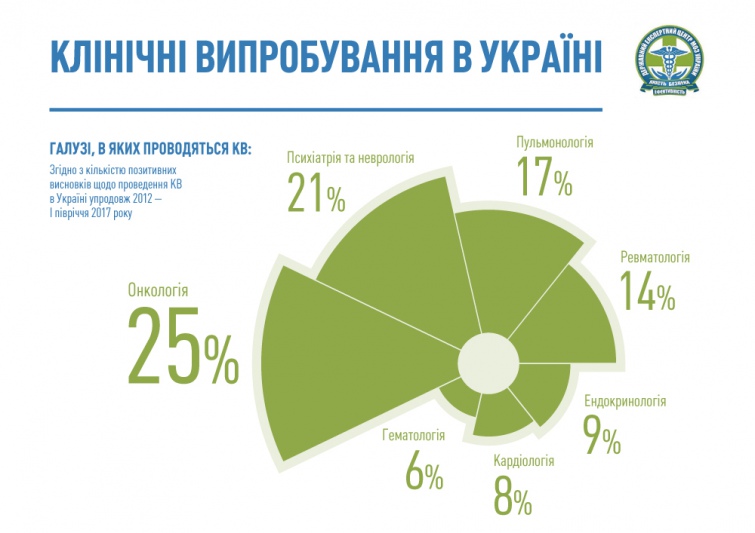 |
| Найбільше – в галузі онкології. Для збільшення натисніть на малюнок |
ЧОМУ В НАС ПРОВОДИТЬСЯ ТАК МАЛО КВ?
Причин багато: складнощі регуляторної політики, оподаткування досліджуваних лікарських засобів.
Більше того, стрімко зменшилась кількість КВ у 2014 році у зв’язку з анексією Криму та розгортанням АТО на сході, адже безліч виробників втратили доступ до матеріалів досліджень і дослідницьких центрів у цих регіонах.
Таким чином зараз виробники ліків часто вирішують обійти Україну стороною, щоб не наразитись на небезпеку втрати даних своїх досліджень.
Водночас те, що дослідження в Україні проводяться на належному професійному рівні, неодноразово підтверджувалося в ході аудитів Управління продовольства та медикаментів США (Food and Drug Administration), а також Європейською Медичною Агенцією (European Medicines Agency).
ЩО ДАЄ УЧАСТЬ У КЛІНІЧНОМУ ВИПРОБУВАННІ ПАЦІЄНТУ?
Це перш за все безкоштовне для пацієнта лікування.
При чому йому забезпечуються не лише досліджувані лікарські засоби, але й препарати супутньої та базової терапії.
По-друге, пацієнт проходить регулярні обстеження та контроль свого стану здоров’я, що не кожен із нас здатен собі забезпечити за звичайних умов лікування.
По-третє, це доступ до інноваційних лікарських засобів. Саме такі ліки – єдина надія на виживання, наприклад, для пацієнтів із онкозахворюваннями на стадіях, коли вже жоден метод лікування не допомагає.
По-четверте, це високий рівень захищеності. Пацієнт бере участь у дослідженні лише зі власного бажання після підписання інформованої згоди, отримує страховку на час участі в дослідженні й має право вийти з нього в будь-який момент його проведення.
Більше того Державний експертний центр регулярно перевіряє, чи відповідає хід проведення КВ заявленим при отриманні дозволу документам.
Якщо ні, то дослідження призупиняють до усунення недоліків або ж повністю припиняють його проведення.
ЩО ДАЄ КЛІНІЧНЕ ВИПРОБУВАННЯ ДЕРЖАВІ?
Для країни це перш за все зменшення витрат на лікування пацієнтів інноваційними препаратами.
Це також можливість у майбутньому зареєструвати ефективний та безпечний лікарський засіб. Адже якщо компанія проводить у країні клінічні дослідження, значить, вона зацікавлена пізніше зареєструвати та випускати свій лікарський засіб на її ринок.
Слід також розуміти, що проведення клінічного випробування – це вливання коштів у розвиток інфраструктури тих лікарень, на базі яких вони проводяться.
Оновлюється устаткування медичних закладів, встановлюється високо технологічне обладнання, що дозволяє обстежувати та лікувати інноваційними методами за найвищими світовими стандартами.
Більше того, всі лікарі, долучені до клінічного випробування, спершу проходять підготовку. Лише за І півріччя 2017 року Державний експертний центр провів навчання для 588 лікарів-дослідників.
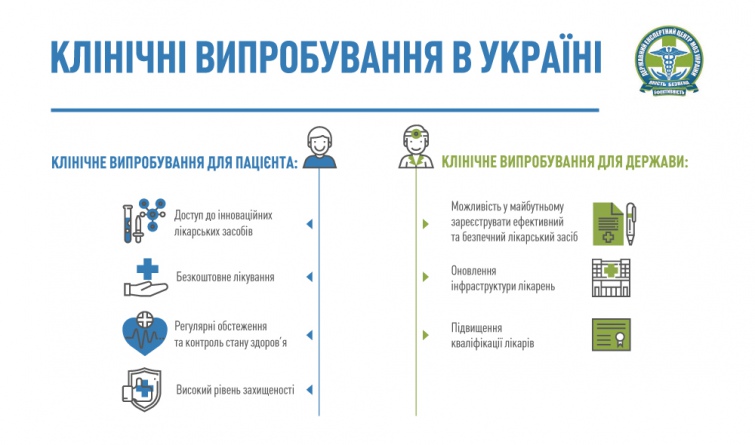 |
| Що дає клінічне випробування. Для збільшення натисніть на малюнок |
ЯК ДІЗНАТИСЬ, ДЕ І ЯКІ ВИПРОБУВАННЯ ПРОВОДЯТЬСЯ?
- На сайті МОЗ чи ДЕЦ (після затвердження протоколу КВ відповідний Наказ розміщується на сайтах МОЗ і ДЕЦ) – там можна дізнатись назву дослідження, місце його проведення, назву та країну організатора, перелік досліджуваних лікарських засобів та їхню лікарську форму та дозування.
- Подати до ДЕЦ запит на надання публічної інформації (детальніше).
Сьогодні на стадії розробки знаходиться електронний реєстр клінічних випробувань, що фіксуватиме, де і хто проводить КВ.
Після завершення дослідження його результати будуть вноситись до реєстру та стануть доступними для усіх зацікавлених осіб: пацієнтів, виробників, лікарів.
Ми всі маємо усвідомити, що без проведення клінічних досліджень неможливе відкриття ліків для подолання таких серйозних світових захворювань, як рак, СНІД, діабет та сотень інших.
Розуміння ролі клінічних досліджень допоможе нашій країні посилити інфраструктуру лікувальних закладів та професіоналізм лікарів, а також рятувати життя сотень тисяч пацієнтів за допомогою інноваційних ліків.
Людмила Ковтун, заступник директора Державного експертного центру
МОЗ України з клінічних питань
